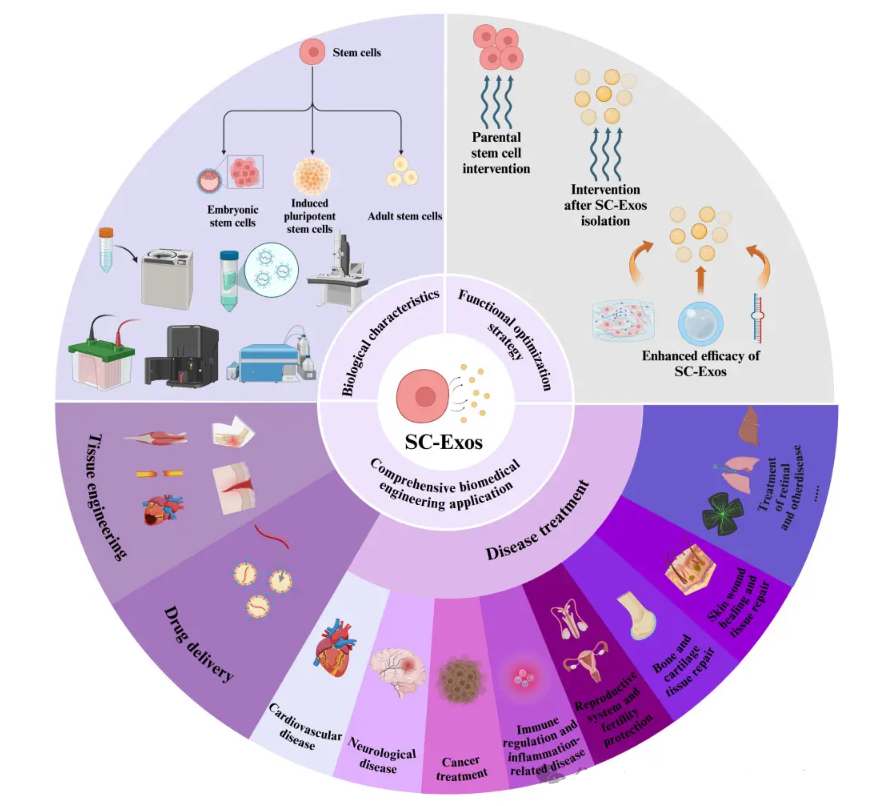
干细胞外泌体,这个听起来有点神秘的名词,其实是细胞间沟通的“小能手”。它个头虽小,直径只有30-150纳米,却有着巨大的潜力。这种小囊泡就像一个“纳米级快递员”,包裹着脂质双分子膜,里面装着蛋白质、核酸(如miRNA)、脂质等生物活性物质。它们的主要任务是给细胞们传递信息,调节受体细胞的功能活动。

干细胞外泌体的来源多种多样,主要有胚胎干细胞来源(ESC-Exos)、诱导多能干细胞来源(iPSC-Exos)和成人干细胞来源(ASC-Exos)。其中,成人干细胞来源的外泌体,尤其是间充质干细胞外泌体(MSC-Exos),因为来源广泛(可以从骨髓、脂肪、脐带等组织中获取)、安全性高、治疗范围广,成为了目前研究最多、临床转化最快的“明星”类型。
外泌体的形成过程就像是细胞内的精密“生产线”。细胞膜内陷形成早期内体,内体成熟过程中向内出芽,形成含有腔内囊泡的多泡体,最后多泡体与细胞膜融合,将腔内囊泡释放到细胞外,就形成了外泌体。这个过程涉及到ESCRT(内体分选转运复合体)依赖和非依赖(如神经酰胺、四跨膜蛋白参与)等多种分子机制,可以说是细胞内的一场“精密舞蹈”。

干细胞外泌体的应用范围非常广泛,几乎涵盖了人体多个系统的疾病。在心血管疾病方面,心梗后心肌细胞大量死亡会导致心脏功能下降。ESC-Exos可以通过传递miR-294促进心肌血管生成和心脏祖细胞激活,减少梗死面积并改善心脏功能;而MSC-Exos则可以通过抑制心肌细胞凋亡,减轻心肌缺血再灌注损伤(比如心脏手术后的二次损伤)。
在神经系统疾病方面,对于中风患者,人脐带MSC-Exos可以携带miR-1228-5p穿过血脑屏障,改善神经元线粒体功能,减轻脑损伤。韩国一家公司研发的SNE-101外泌体疗法已经获批开展1b期临床试验,用于中风治疗。在脊髓损伤中,用磁性纳米颗粒标记外泌体并通过外部磁场引导,可以促进轴突再生和减少炎症。在阿尔茨海默病模型中,MSC-Exos可以通过调节免疫和减少淀粉样蛋白沉积,缓解认知障碍。
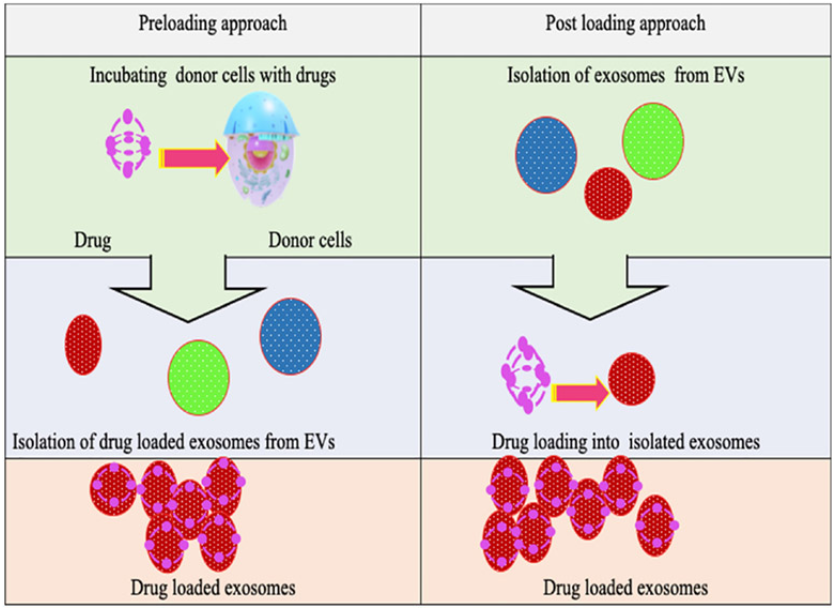
在癌症干预方面,SC-Exos体积小、能穿透肿瘤屏障,是理想的药物递送载体。比如,将化疗药阿霉素装入骨髓MSC-Exos,并修饰针对结直肠癌细胞的适配体,就可以实现精准药物递送,同时降低心脏毒性。向MSC-Exos装载miR-29b,可以抑制胃癌细胞腹膜转移风险。
在免疫与炎症疾病方面,对于炎症性肠病(IBD),人脐带MSC-Exos可以通过传递miR-129-5p抑制肠道细胞铁死亡,减轻肠道损伤。对于类风湿关节炎,脂肪来源的MSC-Exos装载淫羊藿苷后,可以调节巨噬细胞功能,减少关节炎症和软骨破坏。
在生殖系统与皮肤疾病方面,在生殖领域,骨髓MSC-Exos可以通过下调PTEN基因,改善化疗导致的卵巢早衰,促进卵泡再生。在皮肤领域,3D培养的脂肪MSC-Exos结合水凝胶,可以加速糖尿病伤口愈合。外泌体在皮肤修复和抗衰老领域也展现出巨大潜力,能有效促进胶原蛋白生成和修复紫外线损伤。
干细胞外泌体就像是“细胞疗法的2.0版本”,它继承了干细胞的再生能力,又规避了直接移植干细胞的风险。这个领域正在以惊人的速度发展。2025年2月至3月间,海南博鳌乐城国际医疗旅游先行区甚至以“一月两批”的速度发布了《生物医学新技术转化应用实施目录》,其中细胞外泌体技术首次被纳入特许准入细胞治疗目录。
未来,随着技术的不断进步和大样本临床试验的开展(目前全球已有多项I/II期临床试验正在进行),干细胞外泌体有望成为治疗心梗、中风、癌症和自身免疫病等难治性疾病的新武器,为患者提供更安全、精准的选择。