肠道微生物是人体代谢的重要参与者,其生化活动和代谢产物与人体健康有着密不可分的联系。作为人体最庞大、最复杂的微生态系统,肠道微生物本身及其代谢产物不仅能调节人体健康,更在膳食和宿主之间起到了重要的桥梁作用。正如诺贝尔奖获得者Joshua Lederberg曾指出的,人体与人体共生微生物构成了超级生物体(superorganism)。
随着人们对肠道微生物作用的探索,不断有证据表明微生物组失衡会引发体细胞组织的生理反应。不过,在对于微生物组扰动生殖系统方面,学术界此前知之甚少。
2024年5月1日,欧洲分子生物学实验室(EMBL)的Jamie A.Hackett等人在《Nature》上发表一篇名为《Paternal microbiome perturbations impact offspring fitness》的研究论文,表明肠道微生物群是小鼠父系孕前环境和代际健康之间的关键界面。
准父亲肠道微生物群的扰动会增加其后代出现低出生体重、严重生长受限和过早死亡的可能性。这种效应与雄性生殖系统中诱导的生态失调的动态反应有关,包括瘦素信号受损、睾丸代谢物谱改变和精子中小RNA有效载荷的重新定位。研究中定义了一个可调节的“肠道-生殖系轴”,它对环境暴露非常敏感,并通过影响胎盘功能来改变后代的健康。(图1)

研究人员使用非吸收性抗生素(nABX)在等基因雄性小鼠中建立了肠道微生物群失调的诱导模型。应用16S核糖体RNA测序显示,低剂量nABX治疗6周导致肠道微生物群多样性、丰度和丰富度可逆性降低,但这种生态失调对雄性体重、生育能力或生存没有显著影响,并且在nABX停药8周后可逐渐恢复。(图2)

与对照组父亲的后代相比,nABX父亲的后代新生儿(F1)出生体重显著降低,且平均体重在整个发育过程中也处于降低状态。另外,在F1中还观察到一种主要但只有部分基因外显的产后表型,表现为严重生长抑制(SGR),而对照组后代中没有这种表型。(图3)

以及,相对于对照组的后代,经 nABX 处理的 F1 后代的出生后死亡率显著增加。这主要发生在 SGR 后代中,表明死亡率升高与 F1 对生长受限的易感性增加有关。
对 nABX 雄性所生 SGR 后代进行转录组分析,提示大脑和棕色脂肪组织(BAT)中的差异表达基因(DEGs)优先富集于与代谢过程有关的反应组通路。说明父代菌群失调对后代生长、代谢网络和存活存在代际影响,并且这些表型是概率性反应而非确定性反应,因此表现为后代健康风险的改变。
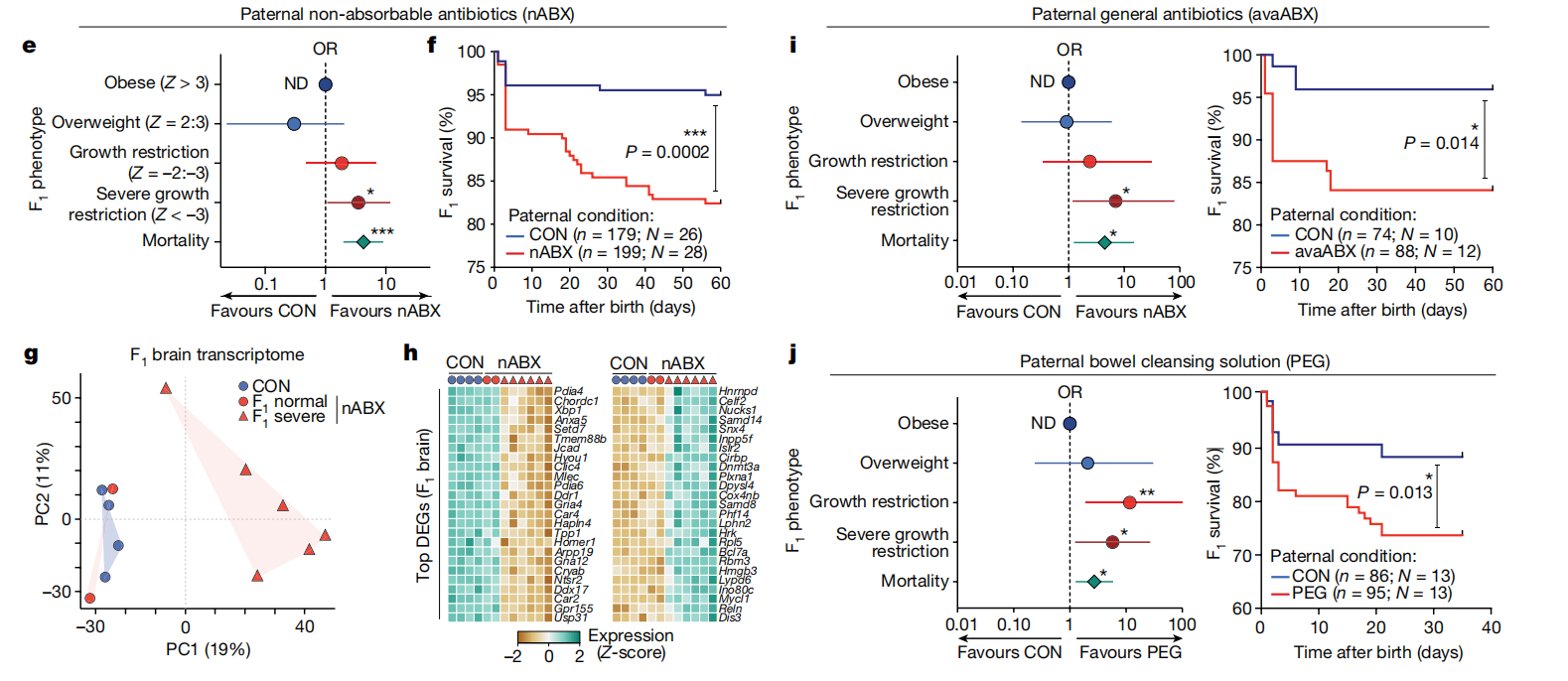
接着,研究人员用几种扰乱父代微生物群的并行策略进行探究,结果与nABX相似。就此,准父亲肠道微生物群的多种不同扰动会增加后代出现发育障碍和过早死亡的风险,这支持了父亲菌群失调与后代健康之间的直接联系。(图4)
研究人员探究了父亲从肠道失调中恢复是否可以挽救F1的表型。nABX停药后恢复期的父亲依旧对F1后代产生影响,而当体内微生物组恢复,F1新生儿体重表型同时恢复并正常发育生长。
转录组学显示,nABX父亲所生的SGR后代与恢复期父亲所生的独立后代,表现出高度相似的基因本体富集,暗示了共同的潜在病因。此外,进一步对SGR后代检测,没有观察到传输的F2效应。这些数据表明,由生态失调的父亲引起的F1表型不是由于基因遗传而产生的差异,并且不会在第一代之后传播。(图5)

为了确认代际遗传的方式,研究人员首先考虑是否肠道微生物组本身存在父系传播。研究表明改变的父亲微生物群不会传播给母亲和后代,后代表型与其父亲的微生物群相关,却不是与其微生物群的本身相关。
一系列实验让研究人员确定,父代微生物群的改变或母代的间接反应都不是出现F1效应的基础。因此,研究人员开始进行体外受精(IVF),以探究F1表型是否特异性地通过父系配子传播。随后发现,父本诱导的F1表型在独立的子宫遗传背景下出现,主要通过配子和共质分子传播。
四、肠道-生殖系轴通过种系传递的现象促使研究人员将目光聚焦在急性肠道微生物群失调诱发的父亲生殖系统的生理变化。观察到nABX雄性动物的睾丸质量明显小于对照组,并发生结构性变化,表明睾丸生理上受到肠道微生物群失调的影响。
分子水平上,观察到nABX期和恢复期与对照睾丸之间有明显的分离,而菌群完全恢复的睾丸代谢组图谱没有区别,这表明代谢物的动态恢复与肠道微生物群的恢复和F1传代效应的逆转同时发生。
研究人员还在菌群失调雄性动物的睾丸中发现了 68 种显著的差异丰度代谢物,这些物质都与生殖细胞功能有关。作者进一步研究了菌群失调雄性睾丸的转录组概况,观察到大体和单细胞水平上有限的表达变化。基因组富集表明,甘油磷脂和类固醇生成相关基因优先出现失调,这与代谢组学特征的改变一致。最敏感的基因是瘦素,该基因编码的激素主要由脂肪细胞产生,但也由生殖细胞产生,在能量平衡和生殖中起关键作用。
累积的证据表明,肠道微生物群扰动会导致睾丸环境发生重大变化,包括代谢物谱、生理学和激素的改变。这表明哺乳动物体内存在一个肠道-生殖系轴,具有重要的平衡功能。父亲对 nABX 的反应之一是瘦素的强烈失调。数据表明,瘦素受到诱导性微生物组失调的系统性调控,受孕前父系瘦素的直接扰动会对子代基因表达程序产生代际影响,这表明瘦素是肠道-胚系轴的重要信号成分。(图6)

接下来,作者试图通过寻找精子中的分子变化来了解肠道-生殖系轴对成熟配子的影响。总体而言,虽然 DNA 甲基化相对稳定,但精子中的小 RNA 组成却在 nABX 介导的菌群失调中发生了改变。考虑到代谢物和激素谱的改变,这表明大分子组成的复合变化会传递给后代。
五、父系菌群失调影响胎盘研究人员从胚胎缺陷的最初来源入手,探究精子影响后代表型的机制。
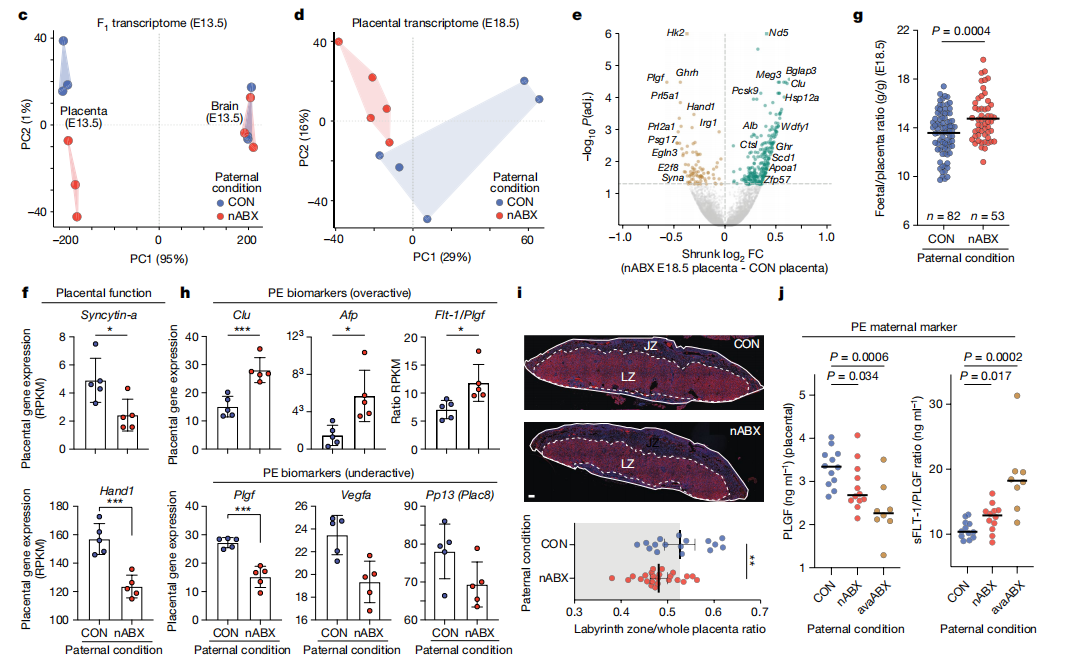
胚胎与对照组相比没有DEGs,相比之下,胎盘转录组表现出强烈聚集,依赖于父本nABX机制。基因表达分析强调了与糖酵解代谢过程、催乳素和类固醇分子代谢以及胎盘发育的几个调节因子(例如基因Hand1和Syna)相关的基因表达的改变,这与胎盘个体发育受损相关。
为了进一步研究菌群失调父亲诱发胎盘功能不全的可能性,研究人员检查了胎盘结构。发现来自nABX父亲的胎盘迷宫区显著减少、血管化明显受损以及胎盘梗死增加。胎盘生长因子(PLGF)激素水平是人类先兆子痫的主要诊断指标,菌群诱导的不良雄性后代在胎盘中PLGF显著降低,sFLT/PLGF比例显著升高。(图7)
综上,累积的证据表明,环境引起的准父亲肠道微生物群扰动会导致相关的生殖影响。说明存在调节性肠道-生殖系轴,当受到干扰时,它可以传播以影响后代患病风险,在部分机制上影响即将到来的胎盘功能。
因此,肠道微生物群可以作为一个主要界面,其中不同的环境输入,如抗生素制度或饮食,可以直接或间接地汇聚并向雄性生殖细胞发出信号,最终对后代产生影响。
此外,在受孕前恢复父系肠道微生物群可以挽救F1表型,说明肠道微生物对生殖的影响是可补救的。鉴于生活方式和抗生素实践的盛行,这可能被证明是减轻不良妊娠结局的一个感兴趣的领域。
研究人员提到,该项实验从直接的分子反应到代际疾病易感性方面,解答了关于环境因素如何跨尺度改变复杂生物系统的问题,并强调了了解这一问题的重要性。
DOI:https://doi.org/10.1038/s41586-024-07336-w
