中东呼吸综合征冠状病毒(MERS-CoV)是致病性最强的人类冠状病毒,该病毒可从自然感染的野生单峰驼向人类传播,构成持续的感染和致病风险。2012年首次在沙特阿拉伯发现,该病毒已导致全球约2600多例病例和900多例死亡。其中绝大多数的感染和死亡病例由沙特阿拉伯王国报告。阿拉伯半岛和非洲的野生单峰驼作为MERS-CoV的主要自然宿主和传染源,从幼龄到成年呈现MERS-CoV抗体逐渐增强的趋势,有的地区抗体阳性率高达90%以上,对单峰驼的免疫保护发挥着重要作用。然而,这些抗体的效价、特异性、结构特征和保护机制不详。目前也尚无获批的MERS-CoV特异性抗病毒治疗药物和疫苗。研究自然感染单峰驼的抗体应答,尤其研究其产生独特的遗传、结构和功能特征的纳米抗体,能为研发MERS-CoV有效防治手段提供优质的候选分子,也为研发高效疫苗提供指导和参考。

2026年2月9日,清华大学基础医学院张林琦教授团队、生命学院王新泉教授团队联合突尼斯大学医学院BalkissBouhaouala-Zahar教授团队,在PNAS期刊在线发表了题为“DecodingantibodyresponsetoMERS-CoVinwilddromedarycamels(解码野生骆驼MERS-CoV自然感染的抗体反应)”的研究论文。该研究首次对野生单峰驼的MERS-CoV抗体应答进行进行了全面深入研究,筛选出一系列具有高效中和活性的纳米抗体。这些纳米抗体可识别病毒刺突蛋白受体结合域(RBD)上尚未被报道的结合与中和位点,遗传与结构功能特征独特,不仅为解析单峰驼的抗MERS-CoV免疫机制提供了新视角,也为MERS-CoV预防和治疗药物的研发筛选出极具潜力的候选分子。
研究团队采集9头野生单峰驼的血液样本,检测血浆抗体对MERS-CoV、SARS-CoV-1、SARS-CoV-2刺突蛋白三聚体及RBD的结合活性,从中和活性最高的单峰驼D17中,通过VHH噬菌体文库构建与筛选得到34条独特的纳米抗体VHH序列。通过阳性纳米抗体VHH的遗传特征分析发现,这些序列具有全新的遗传特征:含异常长的CDR3区(75.7%的序列CDR3≥22个氨基酸),显著长于实验免疫驼源纳米抗体;约26%的序列使用此前未报道的IGHV种系基因,遗传多样性更高,且多数序列含额外的半胱氨酸残基,可形成第二对二硫键增强纳米抗体结构稳定性。
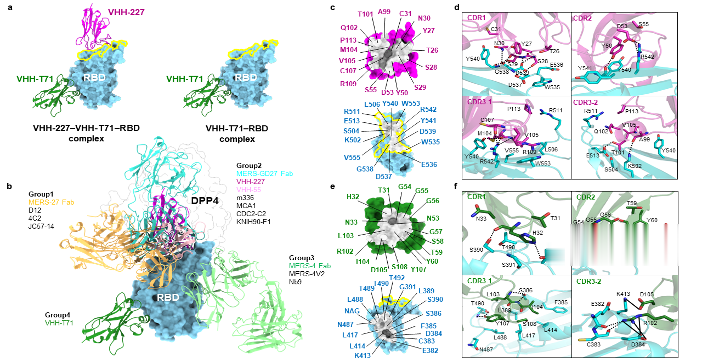
图1.VHH-227和VHH-T71与MERS-CoVRBD复合物结构解析
(摘自文章Figure5)
研究团队选取8株不同系统发育簇的代表纳米抗体构建VHH-hFc融合蛋白深入研究,测试其对MERS-CoVRBD具有高亲和力结合和高效中和活性,解离常数(KD)低至7.71×10⁻¹²M,假病毒中和IC50为1.05~9.55ng/mL,且与SARS-CoV-1和SARS-CoV-2无交叉反应,靶向特异性强。研究团队进而对代表性的纳米抗体VHH-227和VHH-T71开展结构生物学研究,解析其与MERS-CoVRBD形成的二元/三元复合物晶体结构,明确二者在RBD上的结合位点、与RBD的相互作用残基及结合模式,展示出两种截然不同的纳米抗体中和机制:VHH-227结合于RBD的DPP4结合位点,与DPP4的结合区域高度重叠,通过完全阻断病毒受体结合实现100%中和;VHH-T71结合于RBD的核心亚结构域,为首次报道的MERS-CoV第4组表位的抗体,不与DPP4竞争结合,而是通过诱导刺突蛋白S1亚基部分脱落、刺突三聚体聚集的机制实现约80%的中和。VHH-227和VHH-T71靶向的表位在MERS-CoV流行株中高度保守,二者对已发现的MERS-CoV天然RBD突变株及突变组合均保持完全的中和活性,具备应对病毒突变的广谱性。
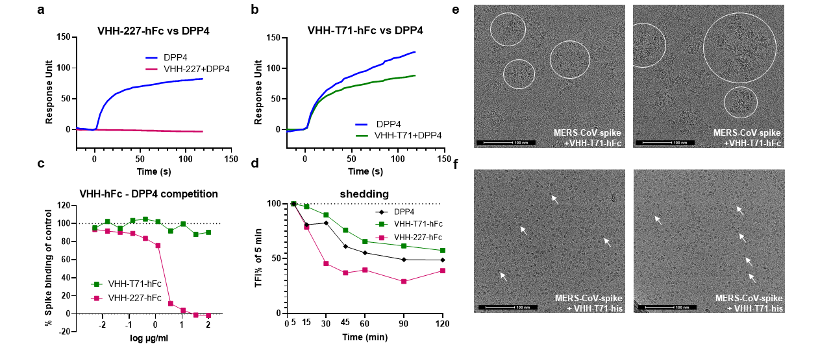
图2.纳米抗体VHH-227-hFc和VHH-T71-hFc的中和机制研究
(摘自文章Figure7)
本研究发现的新型纳米抗体为MERS-CoV防治药物研发提供了极具潜力的候选分子,同时也为解析单峰驼抗MERS-CoV的天然抗体免疫水平、遗传和功能特点、理解冠状病毒的跨物种传播和抗体保护机制提供了重要的依据和参考。
清华大学基础医学院张林琦,生命学院王新泉,突尼斯大学医学院BalkissBouhaouala-Zahar课题组为本论文的共同通讯作者。清华大学与突尼斯大学联合培养学生FatenIdoudi、清华大学出站博士后王若珂、清华大学博士田龙为该论文共同第一作者。本研究得到了中国国家重点研发计划、新发突发与重大传染病防控国家科技重大专项、国家自然科学基金、清华大学专项基金、巴斯德研究所网络以及突尼斯高等教育与科学研究部等的资助。
文章链接
https://doi.org/10.1073/pnas.2513716123