转自:医学界
激素受体阳性/人表皮生长因子受体2(HR+/HER2-)乳腺癌是临床上最常见的亚型,约占全部乳腺癌病例的70%。随着细胞周期蛋白依赖性激酶4/6抑制剂(CDK4/6i)联合内分泌治疗(ET)成为晚期患者的一线标准方案,其生存期和生活质量得到了显著改善。然而,绝大多数患者最终仍会面临疾病进展,如何选择后续治疗方案是临床面临的关键挑战。当前,二线治疗选择不仅包括传统化疗和ET,还涵盖了PI3K通路抑制剂、口服选择性雌激素受体降解剂(SERD)、PARP抑制剂(PARPi)以及新型抗体-药物偶联物(ADC)等[1]。面对众多选项,如何为不同患者制定个体化策略,成为临床医生亟需解决的难题。
当前二线治疗决策的制定,临床主要依据两类因素进行综合评估:一是临床因素,包括患者对前期CDK4/6i治疗的反应持续时间、肿瘤负荷、是否合并内脏转移、基础疾病及患者个人意愿等;二是基因组特征,通过液体或组织活检检测的雌激素受体1(ESR1)突变、磷脂酰肌醇3-激酶/蛋白激酶B/磷酸酶和张力蛋白同源物(PI3K/AKT/PTEN)通路改变等分子标志物,已成为预测药物疗效和指导靶向治疗的关键依据。
2025年7月,CancerTreatmentReviews杂志发表了题为《Keydecisionfactorsinsecond-linetherapy:ExpertinsightsonHR+/HER2-metastaticbreastcancerpost-CDK4/6inhibitorprogression》的综述[2]。该文系统梳理了CDK4/6i联合ET治疗进展后的关键决策因素,并深入阐述了如何将临床特征与分子图谱整合,从而为不同临床情境下的患者制定个体化策略,提供重要的专家见解与临床参考。
专家指导意见/共识概述
本综述通过系统检索与分析现有文献,探讨了HR+/HER2-转移性乳腺癌在CDK4/6i联合ET治疗进展后的决策路径。在专家意见部分,文章着重强调,在一线CDK4/6i联合ET治疗进展后,选择二线内分泌方案必须进行精准的分子评估。其核心在于识别ESR1及PIK3CA等PAM通路的关键改变。样本选择上,建议优先采用组织样本进行基因检测,但需注意储存超过5年的样本或脱钙骨转移标本可能存在DNA降解问题;液体活检作为重要补充手段,虽具微创优势,但其DNA含量较低可能影响检测灵敏度。检测方法需因靶而异:ESR1突变推荐使用RT-PCR或ddPCR等高灵敏度方法;而对于PI3K通路变异则推荐采用靶向二代测序。这种基于分子特征的精准分型,为患者后续靶向治疗选择提供了关键依据。
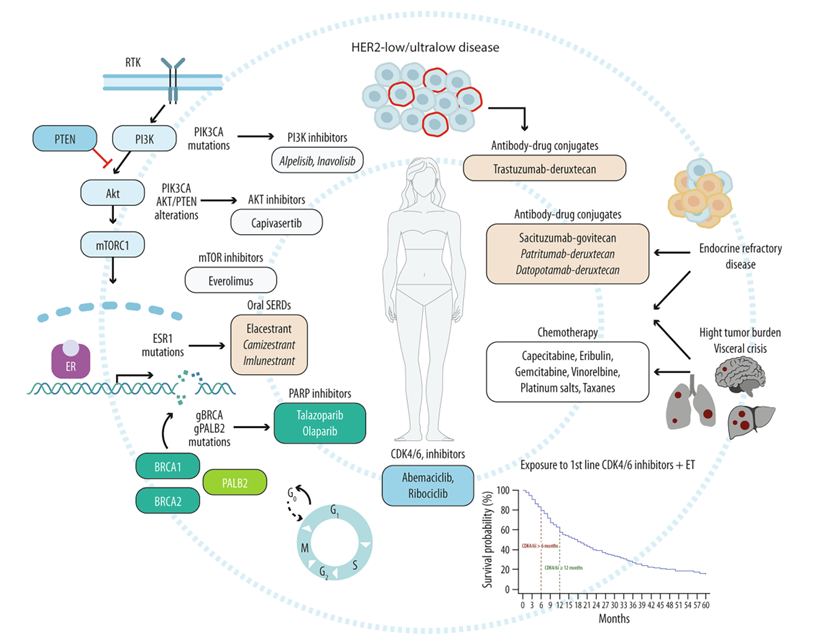
1.CDK4/6i一线治疗进展后的首选治疗方案及其临床决定因素。
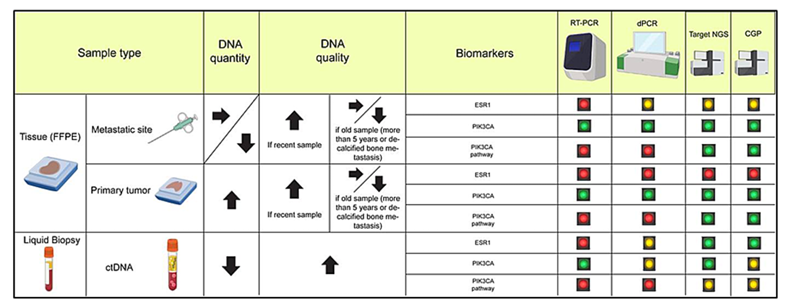
2.根据样本类型和检测方法进行的分子检测。绿色代表生物标志物检测可靠性及准确性高,黄色表示具有一定的实用性但存在潜在局限性,红色则表示对特定生物标志物的适用性低或性能欠佳。
(一)一线CDK4/6i联合ET治疗进展后,无可靶向突变的患者,如何决策?
对于一线CDK4/6i联合ET进展且未检测出靶向突变的患者,其治疗策略主要基于疾病负荷、进展速度及患者耐受性等临床因素综合制定。
氟维司群:单药治疗耐受性良好,但抗肿瘤活性有限,中位无进展生存期(PFS)约为1.9-4.8个月。主要适用于疾病进展缓慢、肿瘤负荷低,或患有多种合并症的高龄患者。
依维莫司联合方案:虽缺乏随机对照试验证实,但回顾性与前瞻性研究显示,其在与氟维司群联用时,中位PFS可提升至7个月,可作为无禁忌症患者的一种有效选择。
CDK4/6i跨线治疗:现有证据存在争议。研究表明,从一种CDK4/6i换用另一种可能带来生存获益,特别是疾病非快速进展的患者,为延迟化疗提供了可行路径。而继续原CDK4/6i的证据尚不充分
化疗:对于肿瘤负荷大、症状明显或需要快速控制疾病的患者,化疗也可作为一种选择
ADC药物:近年来ADC药物显示出卓越的抗肿瘤活性,为CDK4/6i联合ET进展后的治疗探索带来了新的方向,但其带来的毒性特征需谨慎权衡,临床应用中需结合其疗效与特有安全性特征进行决策。
(二)一线CDK4/6i联合ET进展后,携带ESR1突变患者,如何决策?
ESR1突变是HR+/HER2-晚期乳腺癌获得性内分泌耐药的关键机制,约20%-40%患者经芳香化酶抑制剂(AI)治疗后会出现此类突变[3],与持续性雌激素受体激活及不良预后密切相关。
针对ESR1突变,SERD类药物已成为重要的治疗方向。III期EMERALD试验证实,elacestrant在CDK4/6i联合ET进展后的ESR1突变患者中显示出显著PFS获益。amcenestrant与giredestrant的II期研究均未达到主要终点,提示不同药物疗效存在差异。除口服SERD外,其他治疗方案也显示出潜力。依维莫司(mTOR抑制剂)联合方案在不同ESR1突变状态患者中均显示出广泛疗效,已被ESMO指南推荐作为可选方案。CDK4/6i跨线治疗在此类人群中的结果尚不一致,相关证据仍在积累中。
值得注意的是,通过液体活检进行ESR1突变动态监测正成为预测耐药和管理治疗的新策略。总体而言,ESR1突变患者的治疗已形成以口服SERD为核心、联合治疗方案为补充、动态基因监测为指导的精准治疗格局,为克服内分泌耐药开辟了新路径。
(三)一线CDK4/6i联合ET进展后,携带PIK3CA/AKT/PTEN突变患者,如何决策?
在HR+/HER2-晚期乳腺癌中,约50%的患者存在PI3K/AKT/PTEN通路异常激活,其中PIK3CA突变最为常见(40%),其次为PTEN功能缺失(12-15%)及AKT1激活突变(1-4%)[4]。针对这些热点突变的患者,PI3K抑制剂(PI3Ki)与AKT抑制剂(AKTi)均已显示出有希望的疗效。
PI3Ki方面,目前新一代PI3Kα抑制剂inavolisib的III期INAVO121研究正在进行中,旨在进一步评估其在CDK4/6i进展后的疗效与安全性。
AKT抑制剂方面,capivasertib在CAPItello-291研究中表现突出,在PIK3CA/AKT1/PTEN改变的患者中,将中位PFS从3.1个月提升至7.3个月,且该获益在CDK4/6i经治患者中保持一致。
需要注意的是,在临床决策中,由于缺乏不同抑制剂之间的头对头比较,药物安全性成为关键考量。alpelisib常见高血糖等代谢不良反应,而capivasertib整体安全耐受性更可管理,对于合并血糖异常或糖尿病基础疾病的患者,capivasertib可能是更合适的选择。
(四)一线CDK4/6i联合ET进展后,携带ESR1和PIK3CA共同突变患者,如何决策?
乳腺癌对CDK4/6i联合ET产生耐药的过程中,常出现多种基因突变共存现象。其中,ESR1与PIK3CA突变共存约占10%-15%,这类患者通常对氟维司群等传统内分泌治疗反应有限。最新研究表明,新型靶向药物为该类患者带来了突破。EMERALD试验显示,对于同时携带ESR1和PIK3CA突变的患者,elacestrant仍可带来显著的PFS获益。值得注意的是,即使ESR1突变与TP53突变或HER2低表达共存,elacestrant仍能维持效果,提示部分新型药物有望克服共同突变带来的治疗挑战。随着疾病进展,肿瘤克隆会不断演化,因此,重复基因检测,动态监测分子图谱变化,对指导后续治疗至关重要。
(五)一线CDK4/6i联合ET进展后,携带胚系BRCA1/2或PALB2致病性/可能致病性突变患者,如何决策?
在HR+乳腺癌患者中,约3-10%携带BRCA1/2胚系致病突变,0.6%-3%携带PALB2突变。这类患者通常发病年龄较轻,疾病表现更具侵袭性。针对这类人群,PARPi已成为关键治疗选择。III期EMBRACA试验证实,与标准化疗相比,PARPi可显著改善gBRCA1/2突变患者的无进展生存期与生活质量。基于这些证据,国际指南推荐对所有HR+/HER2-转移性乳腺癌患者进行BRCA1/2及PALB2基因筛查,并将PARPi作为CDK4/6i进展后的优先治疗选择。
(六)一线CDK4/6i出现内分泌抵抗或不敏感且疾病进展的患者,如何决策?
内分泌抵抗可分为原发性和继发性两类。前者指初始内分泌治疗6个月内出现疾病进展;后者包括治疗过程中出现ESR1突变等耐药情况。若后续治疗2个月内即出现进展,则提示内分泌不敏感,继续采用内分泌治疗获益有限。对内分泌不敏感的患者,化疗仍是传统选择。近年来,ADC药物如T-DXd、Dato-DXd和SG等,已显著改变了治疗格局,其疗效优于传统化疗,但需特别关注其特有的毒性反应。
(七)一线CDK4/6i联合ET进展后,内脏危象患者,如何决策?
内脏危象指由疾病快速进展导致的严重器官功能障碍,患者生存期通常仅为8-18个月。传统上,联合化疗因其较高的客观缓解率被视为标准治疗方案。尽管RIGHTChoice试验提示CDK4/6i联合ET在部分患者中可能带来与化疗相当的获益,但多药联合化疗目前仍是急性内脏危象的主要治疗手段。近年来,ADC药物在难治性乳腺癌中展现出显著疗效,尽管尚未在内脏危象人群中进行前瞻性验证,但其在内脏转移患者中表现出的高缓解率提示,其未来可能成为重要治疗选择。
(八)CDK4/6i辅助治疗后进展的患者,如何决策?
CDK4/6i在高危早期HR+/HER2-乳腺癌患者辅助治疗中的应用,为后续复发患者的治疗选择带来新的挑战。这类患者复发后可能仍保持一定的内分泌敏感性,因此不应完全排除继续使用CDK4/6i的可能性。治疗决策需综合考虑疾病负荷、无病间隔及前期治疗持续时间等因素。值得注意的是,辅助治疗与晚期治疗阶段的基因组特征可能存在差异,例如,ESR1突变发生率显著较低。随着辅助CDK4/6i应用的普及,亟需真实世界数据指导复发后的精准治疗。
总结与展望
在CDK4/6i联合ET治疗进展后,HR+/HER2-晚期乳腺癌的治疗已步入临床与基因组学并重的精准决策时代。临床层面需综合评估肿瘤负荷、进展速度及既往治疗反应;分子层面则需关注ESR1、PIK3CA/AKT/PTEN基因等关键改变选择靶向治疗。治疗策略上,应遵循"内分泌治疗优先"原则,但对耐药或内脏危象患者需及时转换至化疗、靶向或ADC药物。
展望未来,随着辅助CDK4/6i应用的普及和新型药物的不断涌现,治疗决策将更依赖生物标志物的动态监测与个体化分型。通过整合多维信息,我们有望为每位患者量身定制最佳的二线治疗路径。
参考文献:
[1]MunzoneE,etal.Systematicreviewandmeta-analysisofpost-progressionoutcomesinER+/HER2-metastaticbreastcancerafterCDK4/6inhibitorswithinrandomizedclinicaltrials.ESMOOpen.2021;6,100332.
[2]RobertoB,etal.Keydecisionfactorsinsecond-linetherapy:ExpertinsightsonHR+/HER2-metastaticbreastcancerpost-CDK4/6inhibitorprogression.CancerTreatRev.2025Jul:138:102972.
[3]ChandarlapatyS,etal.PrevalenceofESR1MutationsinCell-FreeDNAandOutcomesinMetastaticBreastCancer:ASecondaryAnalysisoftheBOLERO-2ClinicalTrial.JAMAOncol.2016;2:1310-1315.
[4]VasanN,etal.OverviewoftherelevanceofPI3KpathwayinHR-positivebreastcancer.AnnOncol.2019;30:x3-x