
导语:肥胖和代谢紊乱的治疗为何总是停留在“热量管理”的层面?在临床中,我们可以计算卡路里,却难以精准干预蛋白质这一核心营养素的摄入。蛋白质不仅关系到食欲调控,更牵动寿命与代谢健康,而长期以来缺乏有效手段去实现特异性调节。破解这一难题,正是理解营养与疾病关系、推动精准医学前行的关键突破口。

图源:CMT
肠道激素与营养选择的神秘纽带,破解蛋白质饱腹感的密码在内分泌学领域,营养物质的摄入如何精细调控食欲和食物选择一直是研究的核心问题。尽管已知多种激素参与调节食欲和能量平衡,但关于蛋白质摄入如何特异性地引发饱腹感并影响后续食物选择的机制仍不明确。蛋白质在维持生理功能、促进生长和修复组织方面至关重要,但其摄入过量或不足均可能导致代谢紊乱,如肥胖和营养不良。此外,蛋白质摄入与寿命之间的关系也逐渐受到关注,但具体的分子机制尚未完全揭示。
在临床实践中,目前常用的食欲调节策略主要集中在调节总能量摄入和消耗,而非特异性地针对蛋白质等特定营养物质。这种非特异性调节方法在治疗肥胖和代谢紊乱时存在局限性,难以精准调控营养平衡。此外,现有治疗方法往往忽视了蛋白质摄入对食欲和行为的长期影响,导致治疗效果不理想。因此,开发能够特异性调节蛋白质摄入的治疗策略,对于改善代谢紊乱和延长寿命具有重要意义。
2025年6月,Nature Metabolism杂志发表了一篇题为“Protein-responsive gut hormone tachykinin directs food choice and impacts lifespan”的文章,该研究揭示了速激肽(Tk)这一肠道激素在蛋白质摄入后的调节机制。研究发现,Tk在果蝇和小鼠中响应蛋白质摄入,通过靶蛋白(TOR)和瞬时受体电位A1(TrpA1)信号通路调节食物选择和睡眠模式,甚至影响寿命。这一发现不仅填补了当前研究的空白,还为开发针对蛋白质摄入特异性的治疗策略提供了新的靶点,有望突破现有临床治疗的瓶颈。

本研究是一项多物种、多方法的实验研究,旨在揭示蛋白质摄入如何通过肠道激素调节食欲和行为。研究团队选择了果蝇和小鼠作为模型生物,通过遗传学、生理学和行为学方法,系统地研究了速激肽(Tk)在蛋白质摄入后的表达变化及其对食物选择的影响。实验中,果蝇和小鼠被分为不同的实验组和对照组,分别接受高蛋白或低蛋白饮食。主要评价指标包括食物摄入量、睡眠模式、寿命以及相关激素的表达水平。通过RNA干扰技术,研究者特异性地敲低了果蝇和小鼠肠道中的Tk表达,观察其对行为和生理指标的影响。此外,研究还利用了先进的钙成像技术和基因编辑技术,精确监测Tk+肠内分泌细胞的活动,并分析了其与下游信号通路的相互作用。
速激肽,蛋白质摄入后的关键调节者研究发现,蛋白质摄入显著激活了果蝇和小鼠肠道中的Tk+肠内分泌细胞,导致Tk激素的释放。这一过程涉及靶蛋白(TOR)和瞬时受体电位A1(TrpA1)信号通路。在果蝇中,Tk的释放通过作用于神经内分泌细胞和脂肪组织中的类似胰高血糖素的脂肪激肽激素(AKH),抑制了对蛋白质的进一步摄入,同时促进了对糖类的食欲。这一机制不仅调节了食物选择,还通过影响睡眠模式来适应营养需求。具体而言,高蛋白饮食的果蝇在Tk作用下表现出更少的睡眠,而低蛋白饮食的果蝇则表现出更多的睡眠。此外,抑制Tk的表达可以延长果蝇的寿命,这一效应通过AKH信号通路实现。在小鼠中,研究者也观察到了类似的Tk调节机制,表明这一过程在哺乳动物中具有保守性。这些发现为理解蛋白质摄入如何影响食欲和行为提供了新的视角,并为开发针对肥胖和代谢紊乱的新疗法提供了潜在的靶点。
Tk与AKH协同调节食欲和寿命,Tk在哺乳动物中的保守性与潜在应用进一步的研究揭示了Tk与AKH之间的协同作用机制。Tk通过其受体TkR99D作用于AKH产生细胞,促进AKH的释放。AKH进一步作用于神经元和脂肪组织,调节食欲和代谢(图1a)。在果蝇中,AKH的释放不仅抑制了对蛋白质的进一步摄入,还通过作用于神经元中的AkhR受体,调节了对糖类的食欲和睡眠模式(图1b)。这一机制在维持营养平衡和适应环境变化中发挥着重要作用。研究还发现,AKH信号通路在调节寿命方面也起着关键作用。通过特异性敲低Tk或AKH的表达,果蝇的寿命显著延长(图1c)。这一发现不仅揭示了Tk和AKH在调节食欲和寿命中的重要作用,还为开发针对代谢紊乱和衰老的新疗法提供了新的靶点。
研究团队进一步探索了Tk在哺乳动物中的保守性。通过在小鼠中进行实验,研究者发现小鼠肠道中的Tk+肠内分泌细胞同样响应蛋白质摄入,并通过TOR和TRPA1信号通路调节Tk的表达和释放。这一发现表明,Tk在调节食欲和代谢中的作用在不同物种之间具有高度保守性。此外,研究还发现,高蛋白饮食的小鼠表现出更高的Tk表达水平,这与果蝇中的观察结果一致。这些发现不仅为理解蛋白质摄入如何影响食欲和行为提供了新的视角,还为开发针对肥胖和代谢紊乱的新疗法提供了潜在的靶点。
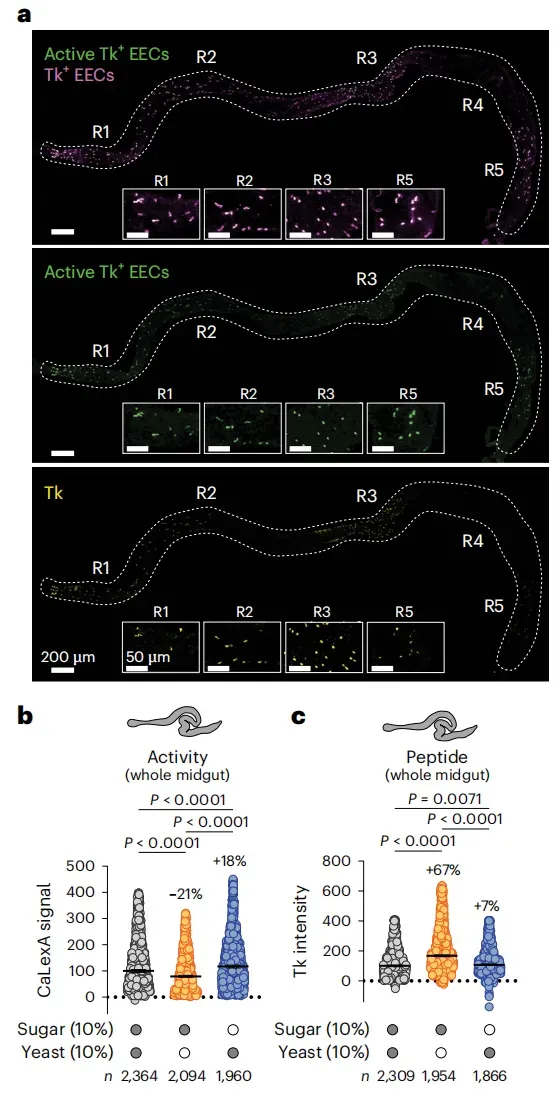
图1 宏量营养素摄入调节Tk⁺ EEC活性和Tk肽释放于交配后的雌性果蝇中
注:(a)来自喂食成虫优化饲料的果蝇的Tk⁺ EEC表达活性报告基因CaLexA的代表性图像。上:Tk⁺ EEC(Tkgut>tdTomato,洋红色)和活化细胞(Tkgut>CaLexA诱导的GFP,绿色)。中:活化的Tk⁺ EEC(GFP)。下:抗-Tk染色。插图:区域R1–R5。比例尺:200µm(整个中肠)和50µm(插图)。在五个独立的肠样本中观察到类似的表达模式。(b)Tk⁺ EEC在整个中肠中的钙依赖性活性(GFP/tdTomato比值)。(c)交配雌蝇喂食糖、酵母或二者同时喂食18小时后的抗-Tk染色强度(Kruskal-Wallis检验与Dunn’s检验)。
总结本研究通过系统的研究设计和实验方法,揭示了速激肽(Tk)在调节蛋白质摄入后的食欲和行为中的关键作用。研究不仅在果蝇和小鼠中验证了Tk的调节机制,还发现了其与AKH信号通路的协同作用。这些发现不仅填补了当前研究的空白,还为开发针对肥胖和代谢紊乱的新疗法提供了潜在的靶点。
在临床实践中,肥胖和代谢紊乱的治疗常常面临挑战,现有治疗方法多侧重于调节总能量摄入和消耗,而非特异性地针对特定营养物质。这种非特异性调节方法在治疗肥胖和代谢紊乱时存在局限性,难以精准调控营养平衡。此外,现有治疗方法往往忽视了蛋白质摄入对食欲和行为的长期影响,导致治疗效果不理想。
本研究的创新之处在于,它不仅揭示了Tk在调节蛋白质摄入后的食欲和行为中的关键作用,还通过特异性敲低Tk或AKH的表达,成功延长了果蝇的寿命。这一发现为理解衰老机制提供了新的视角,也为开发针对肥胖和代谢紊乱的新疗法提供了潜在的靶点。通过调节Tk和AKH信号通路,未来可能开发出能够特异性调节蛋白质摄入的治疗策略,从而更精准地调控营养平衡,改善代谢紊乱,延长寿命。此外,研究还发现Tk在哺乳动物中具有高度保守性,这为将这些发现转化为临床应用提供了可能性。未来的研究可以进一步探索Tk和AKH在人类中的作用机制,并开发基于这些发现的新型治疗策略。这些策略可能包括开发特异性抑制Tk或AKH的药物,或者通过饮食干预调节Tk和AKH的表达,从而实现更精准的营养调控和代谢管理。
参考文献
AHRENTLØV N, KUBRAK O, LASSEN Met al. Protein-responsive gut hormone tachykinin directs food choice and impacts lifespan. Nat Metab. 2025 Jun;7(6):1223-1245. doi: 10.1038/s42255-025-01267-0. Epub 2025 Apr 14. PMID: 40229448; PMCID: PMC12198013.
“医学论坛网”发布医学领域研究成果和解读,供专业人员科研参考,不作为诊疗标准,使用需根据具体情况评估。
编辑:白术
审核:梨九
排版:蓝桉
封面图源:CMT