
导语:PD-1缓解率不足三成,冷肿瘤把T细胞锁在膜外;多线失败后,病床旁还能拿出什么新招?当免疫治疗天花板日益压低,一条由癌细胞主动伸出的“手刹”被悄然揭开,或让耐药患者重燃免疫突围的星火,也为临床医生提供可成药、可组合的全新免疫钥匙。
图源:CMT
PD-1/PD-L1应答率不足三成,肿瘤免疫逃逸另有玄关?三阴性乳腺癌和胶质母细胞瘤一旦复发,临床医生手里真正有效的“热兵器”屈指可数:PD-1/PD-L1抑制剂在TNBC客观缓解率不足15%,GBM更是低于10%,且获益人群在免疫表型上并无明确“红线”可划。更棘手的是,这类肿瘤微环境普遍缺乏CD8⁺T细胞浸润,即便外周给予T细胞输注,瘤内也很快被Treg、MDSC和乏氧代谢物共同构建的“免疫沼泽”吞没。传统策略——化疗联合PD-1再叠加放疗——只能短暂提升抗原负荷,却无法解决TCR信号被持续“静音”的核心矛盾,导致二线以后几乎无方案可选。
过去五年,学界把共抑制分子清单从CTLA-4、PD-1扩展到TIM-3、LAG-3、TIGIT,但临床转化依旧“雷声大、雨点小”。根本原因有二:第一,现有靶点多在T细胞自身,阻断后需依赖既存的完整TCR信号链,而“冷肿瘤”恰恰缺乏这一前提;第二,膜表面免疫调控网络高度冗余,单纯追加检查点抗体常陷入“按下葫芦浮起瓢”的循环。因此,寻找由肿瘤端主动“钳制”TCR近端信号的全新配体-受体轴,成为突破低免疫应答瓶颈的迫切缺口。

2025年3月,Nature Cancer在线发表的“PILRα on tumor cells interacts with the T cell surface protein CD99 to suppress antitumor immunity”正是瞄准这一空白。作者利用EGFR-CAR-T诱导的转录组扰动模型,从肿瘤端挖掘到髓系抑制受体PILRα可直接扣留T细胞共刺激分子CD99,进而锁死ZAP70-NFAT-IL-2级联反应。该机制跳出了“在T细胞上找靶”的惯性思维,为临床提供一条由肿瘤端解除TCR信号“手刹”的全新干预路径,理论上适用于任何CD99⁺T细胞存在的“冷肿瘤”场景。
高通量膜蛋白钓鱼锁定PILRα,人源化+同源移植双模型验证本研究是一项整合RNA-seq筛选、体外人工抗原提呈细胞(aAPC)功能验证及多模型体内疗效评价的多层次转化研究,旨在阐明PILRα-CD99轴的免疫抑制机制并验证其成药可行性。作者先对EGFR-CAR-T处理后的U87胶质瘤细胞进行深度转录组测序,筛选出600个上调≥2倍且编码膜蛋白的基因;结合TCGA生存数据,锁定32个“高表达+预后差”候选分子。随后构建表达抗-CD3 scFv与DAP10/12-CD3ζ-FCER1G信号适配体的aAPC 293T系统,与NFAT-GFP/NFAT-Lucia双报告Jurkat T细胞共培养,一次性功能读出148个膜蛋白对TCR信号的促进或抑制活性,从中挑出PILRα等5个显著抑制分子。体外实验采用健康供者外周血原代T细胞,给予板结anti-CD3(1 μg/mL)±重组PILRα-ECD-hIg融合蛋白(20 μg/mL),以CFSE稀释、CD25/CD69/CD44流式、IFN-γ/颗粒酶B/IL-2 ELISA为主要终点;体内部分则建立三种移植模型:①NCG小鼠颅内U87-luc+人PBMC人源化模型;②NCG小鼠皮下MDA-MB-231+人PBMC人源化模型;③C57BL/6小鼠同源Hepa 1-6及MC38模型。干预措施包括PILRα敲除、过表达、茎区O-糖基化位点突变(T&S→A)以及抗-PILRα单抗C21(10 mg/kg,biw)单药或联合anti-PD-1。主要评价指标为肿瘤体积/荧光强度、小鼠总生存、CD8+ TIL比例与功能分子表达;次要指标包括血清细胞因子、器官毒性病理及Fc受体依赖效应。
PILRα茎区糖链扣住CD99,C21单抗一刀切断免疫刹车PILRα茎区O-糖链缺失即丧失免疫抑制力,图1k–q
将茎区12个Ser/Thr全部突变为Ala(T&S(M))后,PILRα-hIg分子量下降8 kDa,PNA凝集素信号减弱90%。功能层面,突变蛋白对anti-CD3诱导的T细胞增殖抑制率由62%降至3%(图1o),CD25⁺细胞比例由28%回升至56%(图1p),IFN-γ、颗粒酶B、IL-2分泌量恢复至对照水平(图1q)。作者指出,O-糖基化提供了“刚性间隔”,使IgV结构域得以以最佳几何角度钳住CD99,删除糖链相当于“卸了螺丝的扳手”,丧失力学优势。

图1 PILRα黏蛋白茎区对其免疫抑制功能必不可少
注:j–l j免疫印迹:PNA凝集素检测O-糖——ECD阳性,IgV阴性。k 去糖基化酶处理使PILRα条带下移且抑制功能减半。l 酶处理后CD25⁺抑制率由65%降至30%,P=0.0082。m–qT&S(M)突变体分子量↓,PNA信号↓;增殖、CD25、细胞因子分泌与空载体无差异,均P>0.99→证实O-糖基化位点是功能必需。
CD99是PILRα功能性配体而非旁观者,图2c–e、图2i–q
CRISPR敲除CD99(效率87%)后,PILRα-hIg对T细胞增殖的抑制率从58%降至4%(图2c),CD25⁺比例由25%升至54%(图2d),IFN-γ分泌由110 pg/mL升至310 pg/mL(图2e)。相反,敲除CD8α无此逆转效应。竞争ELISA显示,抗-PILRα单抗C21以0.43 μg/mL的IC50完全阻断PILRα-CD99结合(图2k)。作者讨论认为,CD99作为TCR共刺激分子,其胞外段与PILRα结合后“被固定”在脂筏外缘,无法与TCRζ链形成有效顺式簇集,从而直接“掐灭”信号1。

图2 PILRα结合CD99从而抑制T细胞活性
注:a,b CD99或CD8α敲除效率>85%。c–e anti-CD3刺激下,CD99⁻/⁻使PILRα抑制失效,增殖、CD25、IFN-γ与对照无差异;CD8α⁻/⁻无此效应。f,g PILRα-CD99 KD=64 μM;ELISA EC₅₀=2.146 μg/mL。h:FLAG-PILRα与Myc-CD99相互作用;T&S(M)突变结合消失。i,j 抗PILRα单抗C21:SPR KD=4.92 nM;ELISA EC₅₀=75.6 ng/mL;不与IgV或T&S(M)结合。k C21阻断PILRα-CD99,IC₅₀=0.43 μg/mL。l C21仅结合WTPILRα-293T,几何平均荧光79.2vs5.5(突变)。m–oC21(50 μg/mL)逆转PILRα抑制,增殖42%→78%,CD25⁺ 14%→48%,IFN-γ、GrzB、IL-2均恢复,P<0.0001。p,q CD99⁻/⁻ T细胞中C21失去逆转能力→证实C21作用依赖CD99。
PILRα过表达显著加速肿瘤生长并压缩CD8⁺TIL,图3b–m
在人源化U87-luc颅内模型,PILRα过表达组第20天荧光信号比对照高3.8倍(图3c),中位生存缩短至29天(对照42天)。流式显示瘤内CD8⁺TIL由5.1%降至1.4%,四功能阳性(CD25⁺IFN-γ⁺GrzB⁺IL-2⁺)亚群比例由2.3%跌至0.4%(图3f)。皮下MDA-MB-231模型重复出一致趋势:PILRα-OE组肿瘤体积在第28天达1400 mm³,而敲除组仅510 mm³(图3h–j)。作者强调,PILRα表达水平与“T细胞排斥”表型呈线性负相关,提示该轴是冷肿瘤形成的“主动阀门”。

图3 PILRα抑制小鼠模型抗肿瘤T细胞免疫
注:a–cU87-luc颅内人源化模型,PILRα-KD荧光信号↓2.1倍,生存中位42天→55天;PILRα-OE信号↑3.8倍,生存29天。d,e IHC,PILRα-KD瘤内CD8⁺浸润5.1%→12.4%;PILRα-OE相反。f流式,PILRα-KD使四功能阳性CD8⁺TIL提高2.8倍,P<0.0001。g–mMDA-MB-231皮下模型,PILRα-KD肿瘤重量1.0 g→0.4 g;PILRα-OE 1.0 g→1.9 g;突变体无差异。
抗-PILRα单抗C21单药即重塑TME并延长生存,图4b–e、4i–k
在人源化MDA-MB-231模型,C21 10 mg/kg biw方案使肿瘤在第28天体积缩小55%(图4b),重量由1.0 g降至0.4 g(图4d),中位生存由38天延长至58天(图4e)。颅内U87-luc模型中,C21降低荧光信号2.1倍(图4j),生存期由32天延至50天。IHC量化显示,C21组CD8⁺浸润密度提高3.2倍,四功能阳性TIL比例升至6.7%(图4g、m)。作者认为,C21通过“释放CD99顺式簇集”瞬间恢复TCR信号1,相当于在肿瘤内部“就地重启”CD8⁺T细胞,无需额外疫苗或细胞输注。
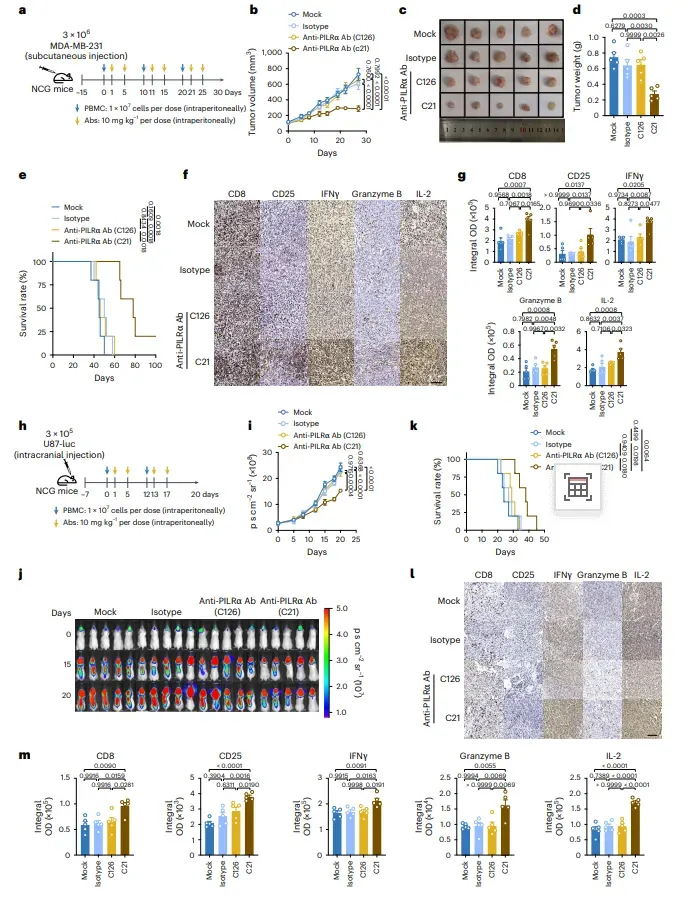
图4 抗单抗抑制人源化异种移植模型肿瘤生长
注:a–gMDA-MB-231模型:C21 10 mg/kg biw,肿瘤体积↓55%,重量0.4 g,生存中位58天(对照38天);CD8⁺及四功能TIL均↑3倍;IgV结合抗体C126无效。h–m U87-luc颅内模型:C21使荧光信号↓2.1倍,生存50天vs32天;瘤内CD8⁺浸润及功能分子同步升高,无器官毒性。
C21与PD-1抗体协同把“冷”GBM变“热”,图5b–d
联合组在U87-luc模型第20天荧光信号仅为单药PD-1组的32%(图5c),中位生存进一步由单药42天延长至>60天(图5d)。IHC显示,联合组CD8⁺TIL密度达8.4%,四功能阳性比例升至10.1%,显著高于任一单药(图5f)。作者讨论指出,PILRα阻断提供“信号1燃料”,PD-1抗体解除“信号2刹车”,二者序贯使用可绕过T细胞耗竭的“死锁”状态,为PD-1耐药GBM提供“二次响应窗口”。

图5 抗PILRα单抗增强抗PD-1免疫治疗的抗肿瘤效果
注:a 实验方案时间轴:NCG小鼠颅内接种U87-luc(3×10⁵,第-7天)→第0天腹腔输注人PBMC(1×10⁷)→第1天起腹腔给予C21、抗PD-1或联合,10 mg/kg,每周两次,直至终点。b–d治疗效应:b 肿瘤生长曲线(生物发光总和):联合组第20天信号较单药再降68%,双因素ANOVAP<0.0001。c 代表性活体图像:联合组颅底荧光几乎消失。d 生存曲线:中位生存单药PD-1 42天、C21 45天,联合组>60天(log-rankP=0.0003)。e,f 免疫组化量化:联合组瘤内CD8⁺浸润密度(e)及CD25⁺、IFN-γ⁺、颗粒酶B⁺、IL-2⁺比例(f)均显著高于任一单药,P<0.01;器官H&E未见毒性。
PILRA高表达是独立不良预后因子,图6a–c
TCGA 10癌种分析显示,PILRA在TNBC、GBM、ESCA等肿瘤表达较正常组织高2.5–6倍(图6a)。Kaplan-Meier拆分高/低表达组,TNBC五年死亡风险比HR=2.24(95%CI:1.15–4.38,P=0.018),GBM中HR=1.55(1.15–2.09,P=0.0036)。TIMER数据库进一步揭示PILRA表达与CD8⁺及CD4⁺T细胞浸润呈负相关,ρ值-0.22至-0.33(图6c)。作者结论:PILRA可作为“免疫排斥”数字病理标志,高表达患者应优先纳入PILRα阻断剂试验。

图6 PILRα在多种癌种高表达并预示不良预后
注:a UALCAN数据库,PILRAmRNA(TPM)在TNBC、CHOL、ESCA、GBM、HNSC、KIRC、KIRP、SARC、THCA、STAD肿瘤组织较正常组织升高2.5–6倍,WilcoxonP<0.001。b Kaplan–Meier生存拆分(高/低表达中位数切点),TNBCHR=2.24(1.15–4.38),P=0.018 ESCAHR=2.17(0.99–4.74),P=0.047 GBMHR=1.55(1.15–2.09),P=0.0036 KIRCHR=1.47(1.04–2.10),P=0.030 STADHR=1.65(1.22–1.98),P=0.036 c TIMER相关性,PILRA表达与CD8⁺及CD4⁺T细胞浸润呈负相关(Spearman ρ –0.22至–0.33,FDR<0.05)。
总结本文以“CAR-T诱导+膜蛋白功能钓鱼”策略,把PILRα从免疫抑制暗网里拎到聚光灯下:其茎区O-糖链像“分子手铐”一样铐住T细胞CD99,切断ZAP70-NFAT-IL-2信号,导致CD8+ TIL失活。靶向茎区的单抗C21能在人源化及同源模型中解除刹车,与PD-1抗体协同把“冷瘤”变“热瘤”,且未现器官毒性。研究同时给出可量化的伴随指标——PILRA表达水平与T细胞浸润负相关、与死亡率正相关——为后续临床试验提供患者富集逻辑。简言之,PILRα-CD99是继PD-1/PD-L1之后,兼具机制清晰度、成药可行性和组合潜力的“第二检查点”,值得加速推向转化。
参考文献
Xia L, Liu JY, Yu C, et al. PILRα on tumor cells interacts with the T cell surface protein CD99 to suppress antitumor immunity. [J/OL]Nat Cancer. 2025;6(7):1184-1201. doi:10.1038/s43018-025-00958-7
“医学论坛网”发布医学领域研究成果和解读,供专业人员科研参考,不作为诊疗标准,使用需根据具体情况评估。
编辑:一诺
审核:梨九
封面图源:CMT