在新冠疫情的阴霾下,即便急性感染的阶段宣告结束,新冠病毒带来的影响却并未就此偃旗息鼓。不少人在“阳康”之后,依旧被咳嗽气喘、腹泻腹痛、心慌心悸等种种问题长期困扰,生活质量大打折扣。
世界卫生组织的数据为我们敲响了警钟:约有10% - 30%的感染者会出现持续数月甚至数年的多系统症状,这便是大家熟知的“长新冠”,也就是新冠后遗症。长新冠绝不是简单的身体虚弱,它的背后,是病毒对人体造成的持续性生理损伤。当人体感染新冠病毒后,自我修复机制可能会受到干扰,炎症持续存在、组织修复延迟,进而引发肺纤维化、慢性胃肠功能紊乱、心肌损伤等一系列长期健康风险,犹如一颗颗隐藏在身体里的“定时炸弹”。

很多人都觉得新冠病毒主要攻击的是呼吸道,然而事实并非如此,它对消化系统的影响同样不容小觑。2026年1月,武汉大学与四川大学的研究团队在《Developmental Cell》期刊上发表的一项研究,为我们揭开了新冠病毒在肠道中“作恶”的神秘面纱。该研究通过对上千名康复医务人员进行追踪发现,超过三成的人在感染三个月后,仍然饱受腹泻、腹痛等消化道症状的折磨。进一步深入分析后发现,新冠病毒能在部分患者的肠道组织中持续存在并进行低水平复制。即便急性症状已经消失,病毒蛋白仍会引发肠道上皮细胞的程序性死亡,破坏肠道屏障,让肠道变得脆弱不堪。
肠道干细胞在维持和修复肠道功能中扮演着至关重要的角色,堪称肠道的“守护者”。但研究发现,病毒刺突蛋白会干扰细胞内的超长链脂肪酸代谢,抑制一条名为“PPAR - 过氧化物酶体”的重要信号通路,导致肠道干细胞分化受阻。这就好比工厂的生产线出了故障,功能细胞的数量不断减少,肠道菌群也随之失衡,腹泻和炎症便会进一步加剧。
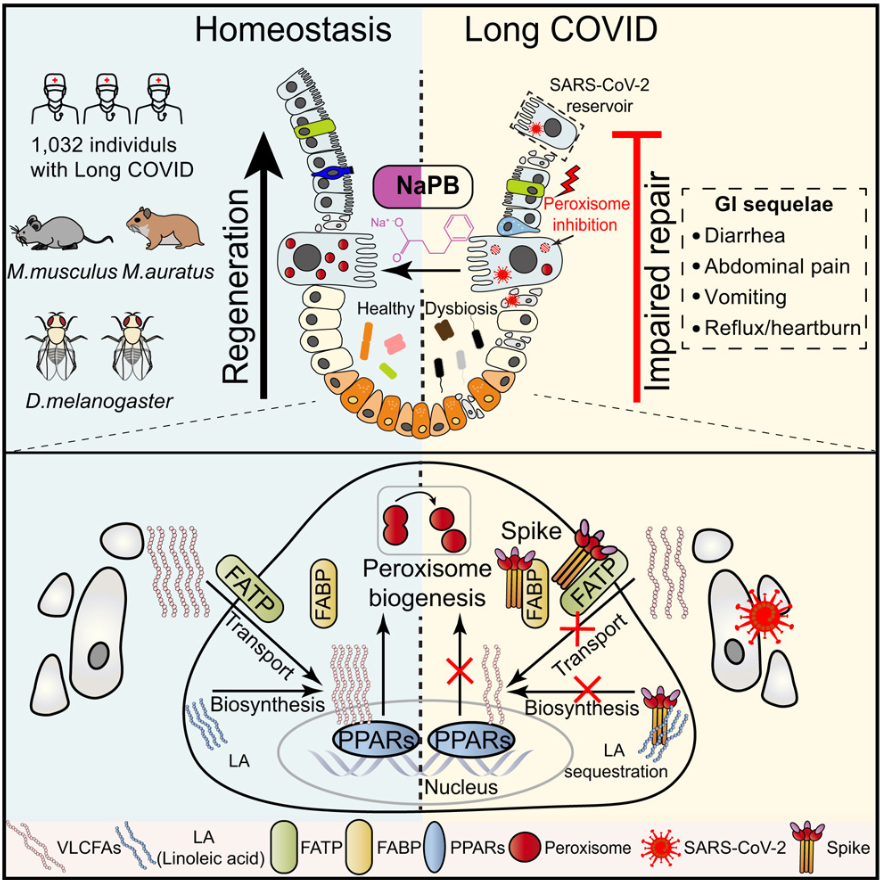
不过,研究团队并没有坐以待毙。他们通过实验发现,激活被抑制的过氧化物酶体通路,能够促进肠道干细胞分化与上皮再生。于是,他们大胆尝试使用两种现有药物——苯丁酸钠和非诺贝特,在动物模型中成功恢复了肠道干细胞的修复功能,缓解了腹泻等症状。这一发现不仅让我们明白了肠道后遗症是如何形成的,也为通过调节干细胞功能来治疗相关症状开辟了新的道路。
长新冠对心血管系统的损害同样不可小觑,它可能会引发心肌炎、心律失常、心功能下降等一系列严重问题。而传统的治疗方法在修复受损心肌和血管方面往往力不从心,存在很大的局限性。
就在这时,干细胞,尤其是间充质干细胞,为心血管修复带来了新的曙光。这类干细胞就像一群“多面手”,具有多向分化能力和旁分泌功能。一方面,它可以分化为心肌样细胞和血管内皮细胞,直接补充受损的组织,就像给受损的建筑填补新的材料;另一方面,它能分泌多种生长因子和抗炎因子,促进血管新生、改善局部血液循环,并抑制过度炎症反应,减少心肌细胞死亡和纤维化,为心脏的康复创造良好的环境。

在动物实验中,间充质干细胞移植已经被证实能够减轻心肌炎症、改善心脏结构和功能。临床研究也传来了好消息:有研究显示,干细胞治疗有助于改善血管内皮功能、缓解心慌症状,并提升心脏的泵血效率(左心室射血分数,LVEF)。左心室射血分数可是衡量心脏泵血能力的关键指标,长新冠患者可能会出现该指标的轻度下降,从而导致胸闷、气短等症状。
更重要的是,干细胞的修复作用具有系统性。它就像一个“全能修复师”,不仅有助于改善心血管症状,还能同步缓解长新冠伴随的疲劳、脑雾等问题。这提示我们,干细胞可能通过调节全身免疫和修复微环境,实现多器官的协同修复,让身体重新恢复生机与活力。
目前,全球已经有超过百项关于干细胞治疗新冠及长新冠的临床试验正在紧锣密鼓地进行中,从基础研究到临床应用的进程正在不断加快。干细胞技术就像一颗冉冉升起的新星,有望突破长新冠“缺乏根治手段”的困境,为数以千万计的患者带来持久康复的新希望。让我们共同期待干细胞技术在未来能够创造更多的奇迹,为人类的健康保驾护航!